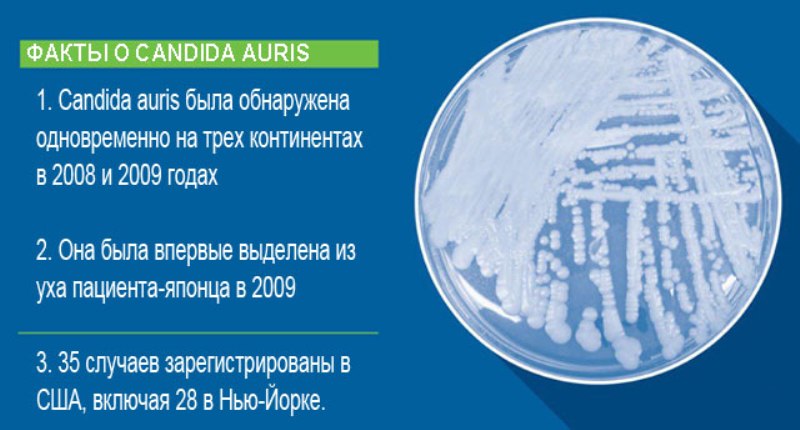
Candida аuris впервые выделена в 2009 г. из отделяемого слуховых проходов пациента из Японии. При обзоре изолятов от 23 пациентов с грибковой инфекцией (фунгемия, хронический средний отит) также выявлен новый вид Candida, схожий с Candida haemulonii. В последующем Candida auris была идентифицирована в образцах, полученных в 1996 г. от пациентов из Южной Кореи.
\
В конечном итоге, Candida auris была зарегистрирована в 27 странах на 6 континентах. Этот грибок является причиной нозокомиальных инфекций, при которых уровень летальности достигает 72%. Такой устрашающий прогноз инфекции Candida auris связан с тем, что грибок обладает множественной лекарственной устойчивостью, которая характеризуется резистентностью к трем и более группам антимикотических препаратов. Особую проблему составляют устойчивость Candida auris к факторам внешней среды и сложность обнаружения при диагностических исследованиях. В последнем отчете Центра по контролю заболеваний США (Centers for Disease Control and Prevention, CDC) Candida auris выделена в группу инфекционных агентов, представляющих наибольшую опасность для общественного здравоохранения. Учитывая нарастающую резистентность к антибиотикам и антимикотическим препаратам, частое бесконтрольное назначение этих групп препаратов, проблема мультирезистентности микроорганизмов должна стать одной из ведущих для мирового здравоохранения. В связи с этим необходимо более тщательное освещение данной проблемы в литературе.
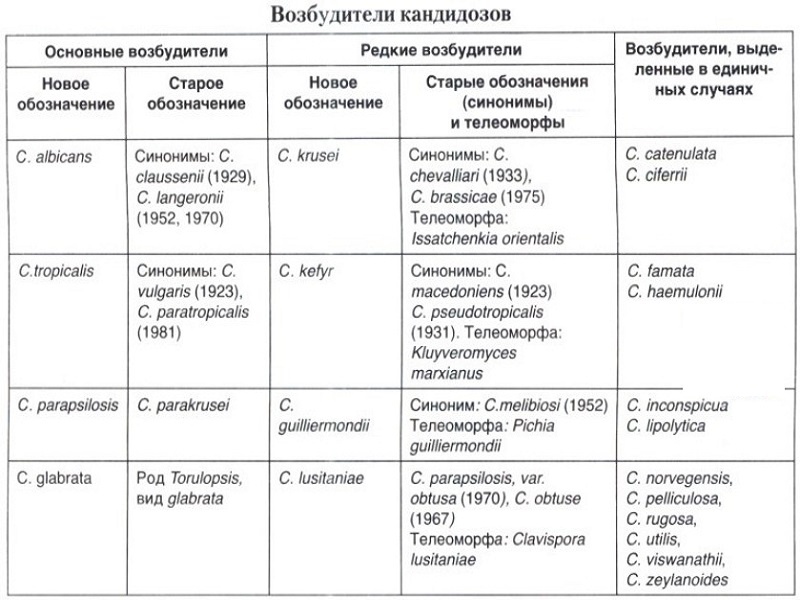
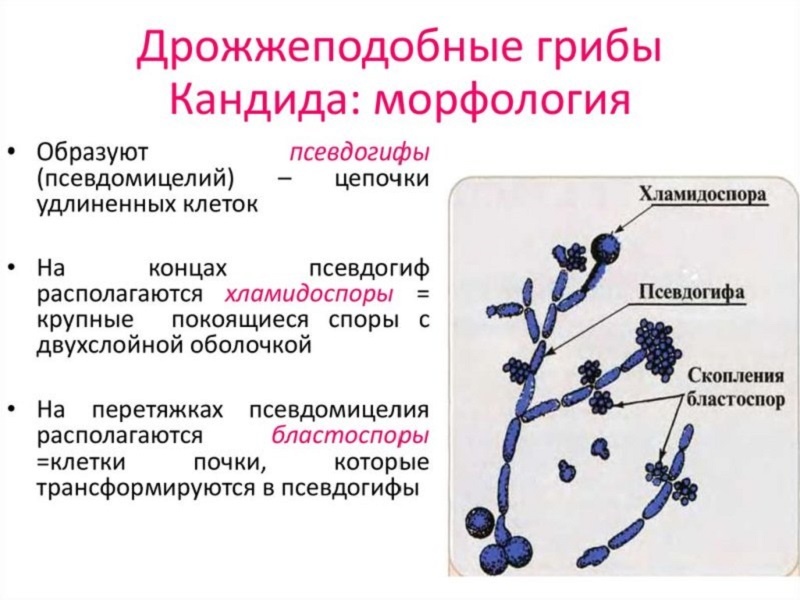
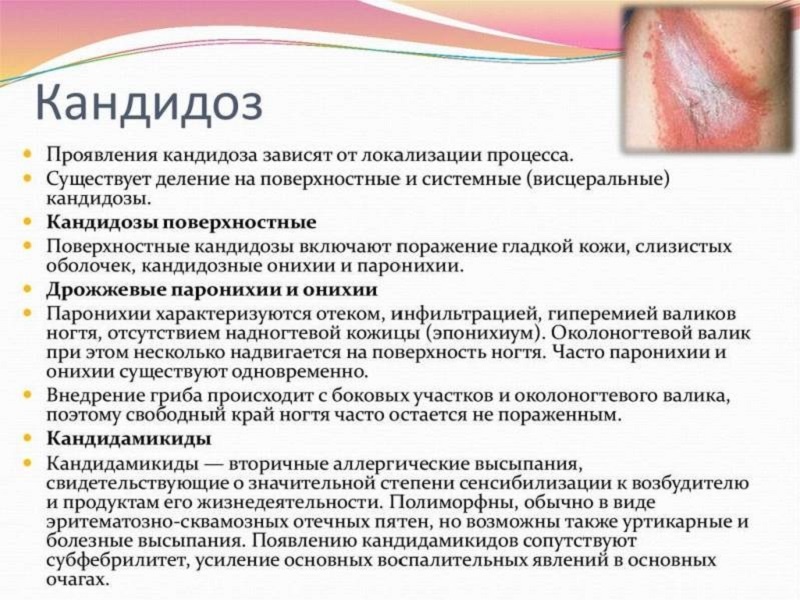
Candida auris: проблема мультирезистентности микроорганизма. Микробиологическая характеристика Candida auris принадлежит к семейству Metschnikowiaceae и филогенетически схожа с Candida haemulonii и Candida Рseudohaemulonii. Представляет собой клетки овальной или эллиптической формы размерами 2,0–3,0 х 2,5–5,0 мкм, которые располагаются одиночно или парами. Этот микроорганизм, в отличие от других представителей рода Candida, не образует гифов и хламидоспор, однако склонен к образованию псевдогифов, что также является отличительной характеристикой этого гриба. Растет на различных средах при температуре 37–42°С, на хромогенных средах (CHROMagar) образует колонии бледно-розового цвета, на сабуро-декстрозном агаре (SDA) образует гладкие белесовато-кремовые колонии. Не растет на средах, содержащих 0,1–0,01% раствор циклогексимида. Биохимически Candida Auris отличается от других представителей рода Candida источниками получения углерода и азота. C. auris способна ферментировать сахарозу, глюкозу и трегалозу, но не мальтозу, галактозу и лактозу. Источником азота является сульфат аммония, кадаверин, L-лизин, источниками углерода — глюкоза, сахароза, D-трегалоза, D-мелизитоза, D-рафиназа, растворимый крахмал, маннит, цитрат, сорбит. Знание отличительных микробиологических и биохимических особенностей, перечисленных выше, важно для идентификации данного организма и разработки новых методов диагностики.
Истинная распространенность инфекций Candida auris остается неопределенной, что связано со сложностью идентификации этого микроорганизма и ограниченностью существующих методов диагностики. Со времени первого выделения Candida auris регистрировалась на разных континентах, в разных странах, включая Российскую Федерацию, где первый случай кандидемии был выявлен в 2018 г. Согласно отчету Европейского центра по контролю заболеваний, в период с 2013 по 2017 г. случаи заболеваний (всего 620 случаев), вызванных Candida auris, зарегистрированы в 6 из 29 стран Европейского союза/Европейской экономической зоны. Согласно данным Центров по контролю и профилактике заболеваний (CDC, США), на конец октября 2019 г. выявлено 911 подтвержденных клинических случаев заболеваний, вызванных Candida auris, и 1830 случаев носительства. В связи с возникновением вспышек заболеваний на разных континентах обсуждался вопрос о распространении инфекции — из одного источника или изолированное возникновение в различных странах.
При проведении анализа результатов секвенирования генома и однонуклеотидных замен в совокупности с эпидемиологическими данными установлено независимое и одновременное появление возбудителя на различных географических территориях. Согласно исследованиям, пациенты, инфицированные Candida auris, всегда имеют тяжелые сопутствующие заболевания и/или получают иммуносупрессивную, антигрибковую и антибактериальную терапию. В числе факторов риска инфицирования упоминаются пожилой возраст, недоношенность, низкая масса тела при рождении, наличие внутривенного катетера, парентеральное питание, искусственная вентиляция легких, пребывание в отделении реанимации и интенсивной терапии, сахарный диабет, вирус иммунодефицита человека/синдром приобретенного иммунодефицита, первичные иммунодефициты, иммуносупрессивная терапия, длительная противогрибковая и/или антибактериальная терапия. Candida auris характеризуется выраженной устойчивостью к факторам внешней среды — способна сохраняться до 2 недель, как на сухих, так и на влажных поверхностях. Колонизация Candida auris обнаружена на многих участках тела, включая ноздри, паховую область, подмышечные впадины, прямую кишку. Считается, что для колонизации пациента или предметов окружающей среды необходимо около 4 ч контакта, а для развития инвазивной инфекции — 48 ч после поступления больного в отделение реанимации и интенсивной терапии.
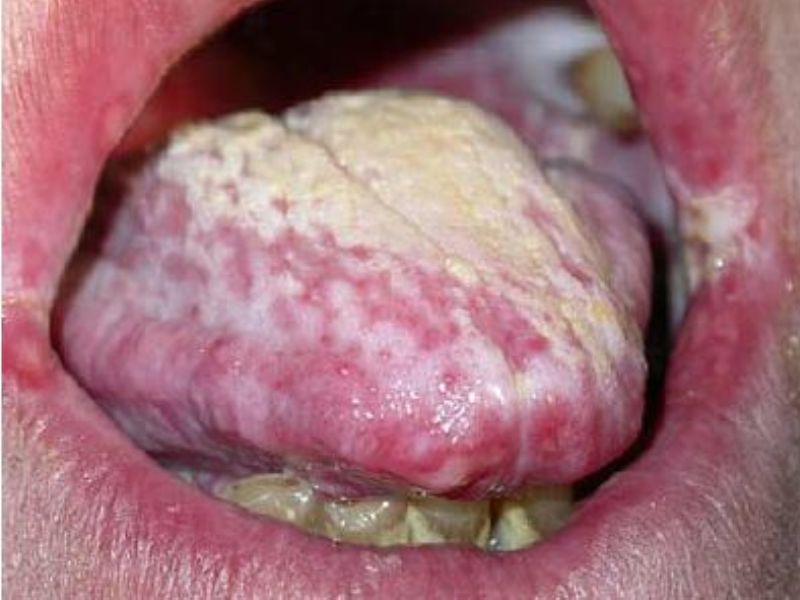
Патофизиология и клинические проявления инфекции. Факторы вирулентности и патогенеза инфекции, вызванной Candida auris, до сих пор малоизучены. В лабораторных исследованиях выявлена продукция фосфолипаз, протеинкиназ, гидролаз; способность к адгезии и образованию биопленок Candida auris снижена по сравнению с Candida albicans. У некоторых штаммов имеется способность к агрегации и образованию больших скоплений клеток, которые невозможно разрушить путем физического воздействия. Заболевания, вызванные Candida auris, обычно протекают в таких же клинических формах, как и при инфицировании другими разновидностями Candida. У многих пациентов возникает фунгемия, также зарегистрированы случаи вульвовагинита, инфекции мочевыводящих путей, пневмонии, абсцессов кожи, менингита, хронического отита, инфицирования ожоговых поверхностей, вызванных Candida auris. Внутрибольничная летальность при инфекции Candida auris оценивается в диапазоне от 30 до 72%. В большинстве случаев колонизация различных участков тела способна сохраняться до 3 мес, даже в условиях лечения эхинокандинами.
Лабораторная диагностика с использованием доступных тест-систем затруднительна ввиду частых ошибок идентификации. В табл. 1 представлены наиболее часто встречаемые ошибочно идентифицируемые микроорганизмы при различных методах распознавания. Наиболее высокой степенью точности, по сравнению с рутинными методами, где используются автоматические микробиологические анализаторы, обладает культуральный метод, однако он не должен использоваться в качестве единственного метода диагностики. Отличительной особенностью Candida auris является их способность расти при температуре 40–42°С. На хромогенных средах образуются полиморфные колонии, различающиеся по цвету (белые, розовые, красные или фиолетовые), способности образовывать агрегаты (скопления клеток). Предложены комбинированные среды CHROMagar + Pal’s agar (изначально разработан для идентификации Cryptococcus neoformans), позволяющие различить Candida auris и Candida haemulonii. В настоящее время рекомендованы два метода лабораторной диагностики Candida auris. Первый метод основан на матрично-активированной лазерной десорбции/ионизации (MALDI-TOF) и способен отличить Candida auris от других видов Candida . Второй метод диагностики — полимеразная цепная реакция в режиме реального времени с секвенированием D1-D2 области рибосомальной ДНК 28s или внутренней области транскрипции (ITS). Данный метод обладает специфичностью до 100% и считается «золотым стандартом» диагностики инфекции Candida auris.
Заключение. Candida auris представляет собой микроорганизм, характеризующийся высокой множественной лекарственной устойчивостью и обусловливающий высокую госпитальную летальность. Инфекция Candida auris встречается повсеместно, но преимущественно у иммунокомпрометированных больных. Основную проблему в клинической практике представляет недостаточная чувствительность существующих диагностических тестов для обнаруженияэ того грибка, что приводит к неверному подбору терапии и увеличивает риск фатального исхода инфекции. Нарастающая лекарственная устойчивость представляет значительную опасность для общественного здравоохранения. Необходимо выработать единую стратегию контроля за распространением резистентных микроорганизмов. Главной задачей должно стать уменьшение факторов риска развития резистентности. Соблюдение принципов рациональной фармакотерапии бактериальных и грибковых заболеваний, уменьшение частоты инвазивных вмешательств, сокращение времени пребывания в стационаре являются главными мировыми тенденциями в целях профилактики роста лекарственной устойчивости микроорганизмов. В нашей стране существует негативная практика повсеместного назначения антибиотиков, антимикотиков вне показаний и с целью профилактики. Только с помощью надлежащего государственного контроля, повсеместного перехода на современные протоколы лечения, основанные на принципах доказательной медицины, непрерывного обучения врачей можно добиться положительных изменений и уменьшения риска нарастания устойчивости к антимикробным препаратам.

Candida auris — грибок из рода Candida, впервые обнаруженный в ухе пожилой японки в 2009 году (видовое название происходит от латинского слова «ухо»). Он относится к так называемым оппортунистическим инфекциям — то есть практически не угрожает здоровым людям, зато нападает на пациентов с ослабленным иммунитетом (о двуличности таких микроорганизмов мы уже рассказывали в статье про Нистатин). Причем ослабленным не из-за нехватки свежих овощей в рационе или короткого недосыпа, который может случиться с каждым, а после химиотерапии, из-за ВИЧ, диабета или других тяжелых заболеваний. Также в группе риска находятся пациенты в реанимации, новорожденные, чей иммунитет еще не успел как следует сформироваться и настроиться, пожилые люди, курильщики и те, кто принимает стероиды для лечения аутоиммунных заболеваний.
В центре внимания авторов уже упомянутой статьи в NYT — описание случая в госпитале Маунт Синай, пациент которого погиб из-за инфекции. Хотя зараженного изолировали в реанимации, после его смерти грибок распространился по всем поверхностям в палате — кое-где пришлось перестелить половицы и менять потолок, так как обеззаразить их не удавалось. Но это лишь яркий пример. Саму проблему уже давно нельзя оставить за дверями реанимационной палаты в Бруклине: последние пять лет грибок продолжает победоносное шествие по миру, заражая новорожденных в Венесуэле, пациентов испанских больниц, африканских бедняков и богатых англичан. Но медики не любят говорить о нем — и страх играет в этом не последнюю роль.
В нашем интернет-магазине есть эффективные сборы для решения проблем с кадидозом. Приобрести их можно ЗДЕСЬ >>>